6-08-1: 核反応式
これ以後は原子物理の3大分野の最後 ー 原子核の物理 ー に入っていきます。
※ ページ最上部の(一部スマホでは右上または下側の \(\equiv\) 印「メニュー」をまずクリックしてから)各分野のタイトルをクリックすると、 目次 が見れます。また、スマホは画面を横長にして見ることをおすすめします。
ポイント
・ 原子核 \(^{A}_{Z}\text{X} \) (X: 元素名、\(Z\): 原子番号、\(A\): 質量数または核子数)
中性子数は\(A-Z\)
・ 核反応・放射性崩壊では、電荷保存則と核子数保存則が必ず成り立つ
まずは基本的なことから押さえていこう。原子(大きさはざっと10\(^{-10}\)mから10\(^{-9}\)m)は、その中心に原子核(大きさはざっと10\(^{-15}\)mから10\(^{-14}\)m)という極微の(多くは)球状体を持ち、その周りを電子が取り巻くように分布する。原子に比べて原子核の大きさは、10万分の1程度と極めて小さいというイメージを持っておくことが大事である(図1)。一方、質量は原子核の方が電子よりも10\(^3\)から10\(^{5}\)倍くらい重い。原子核の構成要素は陽子と中性子。陽子は電気素量\(e\)の正電荷(電子の電荷は\(-e\))を持ち、英語でprotonというのでしばしば p と表記される。中性子は電荷が0で、neutronというのでしばしば n と表記。ついでながら電子はelectronで\(e^-\)と書いたりする。陽子も中性子も大きさは10\(^{-15}\)m程度でほぼ等しく、質量もほぼ等しい。陽子と中性子をひっくるめて核子という。
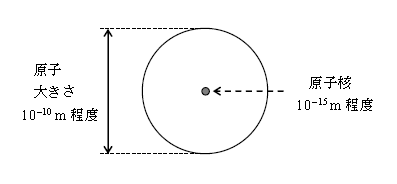
実際には原子核は、原子に比べて、この図の比較スケールよりもっともっと小さい
炭素原子核(または原子)を例に取ると、その表記法は\(^{12}_{\; 6}\text{C} \)のようになる。Cは元素名。左下の6は原子番号で陽子数に等しい。左上の12は質量数とも核子数ともいう。つまり、
左上の核子数12ー左下の陽子数6=中性子数6 である(図2(a))。
一般の原子核(または原子)を表すときには \(^{A}_{Z}\text{X} \) のように書く(X:元素名、\(Z\):原子番号、\(A\):核子数(質量数))。中性子数は\(A-Z\) 。また、この表記法に従って中性子を\(^{1}_{0}\text{n} \)と書くこともある。
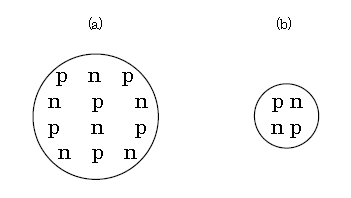
陽子pと中性子nの分布もあくまでイメージである
同位体とは、原子番号は同じだが核子数(中性子数)の異なる原子核を持つ原子どうしのこと。たとえば\(^{12}_{\; 6}\text{C} \)、\(^{13}_{\; 6}\text{C} \)、\(^{14}_{\; 6}\text{C} \)は互いに同位体である。なお、読み方としては「炭素の12」「炭素の13」のように読む。炭素が原子番号6であることは周期表からすぐ分かることなので、左下の6は通常読まない。
核反応式はたとえば次のように書ける。
\(^{2}_{1}\text{H}+ ^{3}_{1}\text{H} →\;^{4}_{2}\text{He} +^{1}_{0}\text{n} \)
これは重水素\(^{2}_{1}\text{H}\)と三重水素\(^{3}_{1}\text{H}\)がくっ付いて(核融合して)\(^{4}_{2}\text{He}\)になる際、中性子nを放出する反応。核反応及び6-09-1の放射性崩壊ではエネルギー保存則が成り立つのみならず、以下の2つの保存則も成り立つ。
電荷保存則:左下の陽子数を見ると、左辺の電荷は1+1=2、右辺は2。よって
反応前の電荷\(2e\)=反応後の電荷\(2e\) が成立(なお、中性子の電荷は0)。
核子数保存則:左上の核子数を見ると、左辺の核子数は2+3=5、右辺は4+1=5。よって
反応前の核子数5=反応後の核子数5 が成立。
この2つの保存則は、実験的な反例が1つも見つかっていない重要な法則である。
核反応式の今一つの例としては
\(^{235}_{\; 92}\text{U}+ ^{1}_{0}\text{n} →\;^{92}_{36}\text{Kr} +^{141}_{\; 56}\text{Ba} +3\,^{1}_{0}\text{n} \)
これは\(^{235}_{\; 92}\text{U} \)が中性子nと反応することにより、2つの原子核\(^{92}_{36}\text{Kr} \)、\(^{141}_{\; 56}\text{Ba} \)に分かれて(核分裂して)、中性子3個を放出する反応。電荷保存則(92=36+56)と核子数保存則(235+1=92+141+3×1)が成り立っている。


